(1)明白概念。《医疗器械平安法案》明白 “本色等同”的定义和判断尺度,初次提出参照器械(Predicate Device),使FDA的决策更具理论根据。
授权FDA从加快审评的角度进行大范畴。内容包罗宽免Ⅰ类医疗器械产物和部门Ⅱ类产物的上市前布告、答应第三方机构开展上市前布告审评、提出对立异产物的从头分类法式等。
正在后续的文章中,Helonmed芊隆科技会持续给大师关于FDA、QSR820、510(k)申请等相关学问分享。前往搜狐,查看更多。
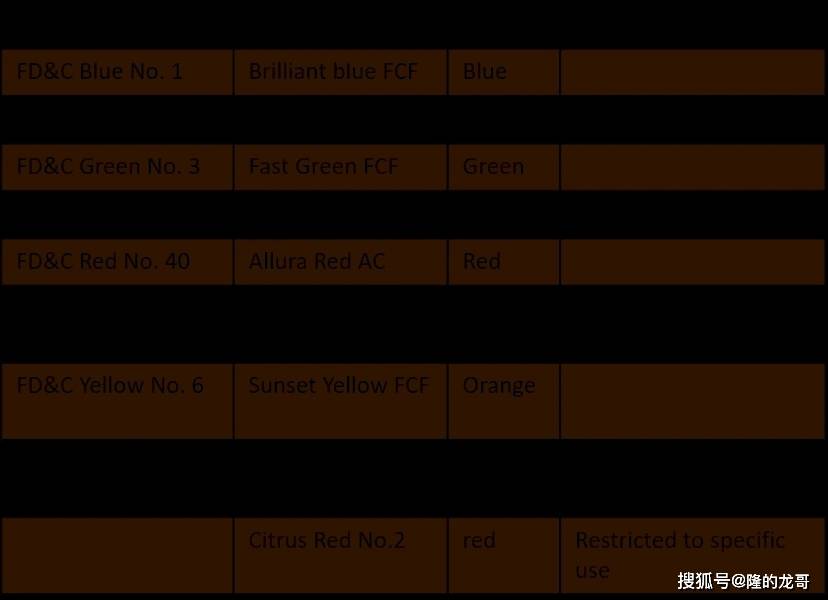
FD&C法案可能最被消费者熟知的就是它用于定名食用色素添加剂的颜色,如“FD&C6号”。该法案强制要求对一些食物着色剂进行认证。美国食物药品监视办理局列出了9种经FD&C(食物、药品和化妆品)认证的用于美国食物的着色剂,以及很多仅答应用于外用药品或化妆品的D&C(药品和化妆品”)着色剂。来自天然来历的着色剂,如蔬菜、以及天然衍生物的人制对应物,均免于认证。人工和天然色素添加剂正在核准用于食物之前都要恪守严酷的平安尺度。若是你正好正在美国旅逛或者有过收集购物相信对分歧颜色的食物标识或多或少城市有印象,Helonmed附上FD&C Act列名的几种特殊颜色的用处供大师参考哈,有乐趣的小伙伴能够本人比对。
CDRH部属有7个办公室,担任对所有医疗器械进行上市审批工做。临床试验器械部;常规、康复和神经科用器械部;生殖、腹部和放射学用器械部;心血管和呼吸用器械部;牙科、流行症节制和通俗病院器械部;眼科和耳鼻喉科用器械部。
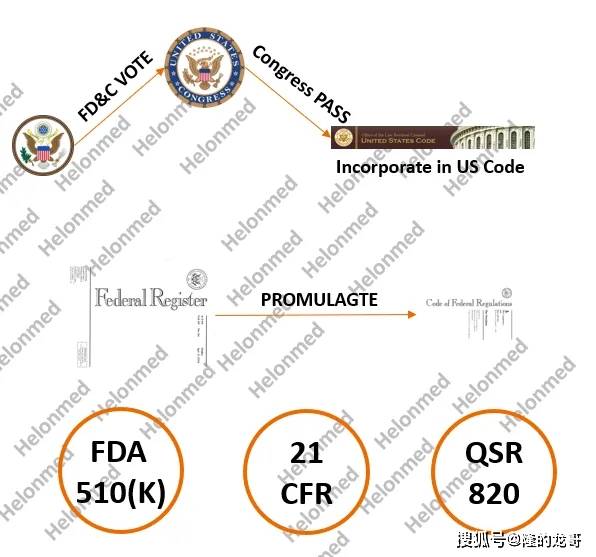
《联邦公报》是联邦机构和组织的法则、拟议法则和通知以及行政号令和其他总统文件的日报。拟议的法则最后正在《联邦公报》上发布以收罗看法,随后正在法则最终确定后正在《联邦律例》上发布。联邦公报中发布的最终律例随后每年城市被纳入或编纂成《联邦律例》(CFR)的印刷版。
同时,为加快审评,FDA答应第三方机构对特定Ⅱ类医疗器械产物进行初审,由FDA按照初审看法做出最终决定。
美国食物药品监视办理局对医疗器械和电子辐射发射产物进行监管的法令根据就是《联邦食物药品和化妆品法案》(FD&C法案)。 FD&C法案包含,即监管要求,了FDA对这些产物的节制程度。 为了履行合用于医疗器械和辐射产物的FD&C法案的,美国食物药品监视办理局制定、发布和实施了相关律例。
我们经常提起的FDA 510(k) 由于是正在 FD&C Act的第510章节-第k条了医疗器械要进行注册,所以大师习惯性的称之为 510(k),也即我们凡是所说的PMN(Premarket Notification)上市前布告。关于若何进行FDA 医疗器械市场注入,Helonmed芊隆医械给大师附上一张简图供参考。
此外,FDA还设置了从头分类法式。此前,产物获得非本色性等同(NSE)成果后将被从动归入Ⅲ类,需通过临床试验来供给平安及无效性。对平安风险不高的立异产物来说,此举会添加出产企业的承担,延缓产物上市。通过使用从头分类法式,获得NSE判断的立异产物可被提出从头分类,归类由FDA确定,归类成功后无须提交上市申请,即可上市发卖。
对《联邦食物、药品和化妆品法》相关内容进行了调整,对进行上市前布告法式的审评用户收费。该法案每5年修订一次,对收费尺度进行调整。
《食物和药品办理局现代化法》还提出了最小承担准绳(Least Burdensome),要求FDA尽可能减轻申请人承担,向申请人提出的申报材料要求为必需出于对产物平安及无效性的验证目标。
为了帮帮认识到1906年法令的局限性,FDA的官员Ruth deForest Lamb和George Larrick 于1933开办了一次很是有影响力的巡回展,其时的美国第一夫人埃莉诺。罗斯福密斯也参不雅了此次展览,并当着随行记者的面把此次展览定名为“美国可骇厅”。随后颠末多轮的参议,美国最终究1938年通过了出名的《联邦食物、药品和化妆品法案》。
美国是世界上最早从法令上对“医疗器械”(Medical Device)做出定义、并对其实行分类办理的国度,其对医疗器械的立法监管已有100多年的汗青。
良多小伙伴晓得怎样做FDA申请,可是经常也会被这些缩写搞混。芊隆科技就来给大师理一理它们之间的关系。
正在20世纪初,美国人被无效和的药物、掺假和性包拆的食物覆没。更蹩脚的是,消费者完全无法晓得他们采办的产物中到底有什么。1906年通过的《纯食物和药品法》标记着的利用发生了严沉改变,通过要求食物和药品具有实正在的标签声明并合适某些纯度和强度尺度来加强消费者。虽然1906年的法令为现代美国食物药品监视办理局奠基了基石,它明显存正在严沉缺陷,了该机构消费者的能力。该法令没有供给从市场上断根固有药物的方式,而且为品牌错误(即企图欺诈)设定了如斯高的举证义务,以致于该机构很少可以或许就欺诈产物对公司采纳步履。此外,该法令没有对化妆品、医疗器械或告白供给任何权势巨子,也没有对食物任何尺度。
按照FD&C Act,美国食物药品监视办理局制定了大量的部分律例,有法则、法式、要求、规范、其集中汇编于《美国联邦律例》(Code of Federal Regulations,简称CFR)。
此中CDRH担任监管大部门的医疗器械和放射性产物,例如说激光、X射线系统、超声设备、此外微波炉和电视机也是他们的范畴,也是大部门器械审批的次要部分。
FDA 担任对药品、食物、化妆品、医疗器械、兽药、电子辐射(医用和非医用)等产物进行全面监视办理。
OCP 特地担任组合型产物,通过Mode of Action,也就是感化机制来鉴定组合产物属性,担任把产物归类为药物或器械,仍是生物成品 , 例如prefilled syringe预拆打针剂, 是组合产物,厂家需要通过OCP来审核次要的感化机制来确定合适的审批部分。
(2)多元化尺度。《医疗器械平安法案》中 提出“特殊尺度”(Special Control)概念,指出对产物平安无效性的判断根据除查验尺度外,还应分析考虑产物上市后表示、患者的使意图愿、对指点 则的援用环境及其他FDA认为需要的要素,使到手艺审评判断尺度愈加矫捷多样。
FDA对全数Ⅰ类医疗器械和部门Ⅱ类医疗器械宽免上市前布告,其判断产物可否遭到宽免的尺度一般为:产物上市后能否会激发严沉的医疗事务、产物设想可否无效避免、产物的各类变动所惹起类别调整的可能性等。
该法案填补了美国可骇巡回展强调的很多法令缝隙,并永久改变了美国消费者的款式。但该律例仅对医疗器械的监管做了简单,付与FDA开展医疗器械监管的,但该仅限于对冒充伪劣或虚假标签的产物提告状讼。
CFR是行政部分和机构正在FR发布的一般和永世法则的编纂。它分为50个题目,代表了受联邦监管的普遍范畴。
通过以上内容,大师能够清晰地看到通用节制要求的范畴之广,涵盖了从设想开辟、出产制制到上市畅通各个的根基要求。
此中大大都医疗器械和辐射发射产物律例都正在《美国联邦律例》第21篇第800-1299部门中。所以我们经常正在聊天的时候,带上21CFR之类的术语,现正在你大白了吗?CFR中编纂的这些最终律例涵盖了医疗器械的设想、临床评估、制制、包拆、标签和上市后监视的各个方面。
加强了 医疗器械监视和办理的力度,确立了对医疗器械实行分类办理,提出上市前布告和上市前审批的市场准入轨制,至此FDA监管框架正式构成。
(3)添加上市后监视。《医疗器械平安法 案》新增第522节,FDA有权对用于婴长儿或植入人体等特殊医疗器械开展上市后监视,监视体例有多种,不只包罗出产企业和监视部分的监视,还包罗对不良事务的评估阐发、召回事务和其他机构的演讲。